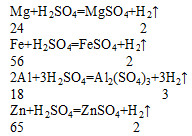兩種金屬粉末的混合物30 g����,與足量的稀硫酸反應(yīng)�����,只生成氫氣1 g��,則這種混合物中的兩種金避可能是( )
A.Mg和Al B.Zn和Fe C.Mg和Fe D.Al和Fe
審題與思路:由題意可知��,題中提供的金屬有四種����,它們與稀硫酸反應(yīng)的化學(xué)方程式如下:
2 無論是哪一個化學(xué)方程式�����,我們都可以使氫氣前的化學(xué)計量數(shù)為1���,使氫氣下面對應(yīng)的相對分子質(zhì)量均為“2”�����。這樣我們不妨設(shè)金屬混合物的化學(xué)式為R(在其化合物中顯+2價)�,其平均相對原子質(zhì)量為X,則有:
R+2HCl === RCl2+H2↑
x 2
30 g 1 g
即得金屬混合的的平均相對原子質(zhì)量為60����。 由題目所提供的答案我們可以分析出答案為B,因?yàn)閷τ贏來說Mg的相對原子質(zhì)量為24�,Al的相對原子質(zhì)量雖為27��,但當(dāng)氫氣下的相應(yīng)相對分子質(zhì)量為2時�����,我們可以把Al的相對原子質(zhì)量看成是18�。而24和18相混合,所得的平均相對原子質(zhì)量只能是大于18且小于24�����。
如此類推���,B中Zn�����、Fe的相對原子質(zhì)量分別為65���、56�,則它們混合后所得的混合的的平均相對原子質(zhì)量為小于65且大于56的數(shù)���。題中x平均相對原子質(zhì)量正好在這一數(shù)當(dāng)中���,故選B。
C中���,Mg�����、Fe相混合后���,平均相對原子質(zhì)量應(yīng)為一個小于56且大于24的數(shù);D中Al、Fe相混合���,其平均相對原子質(zhì)量為一個小于56且大于18的數(shù)����。
注意:①要理解Al的相對原子質(zhì)量應(yīng)為27,為什么這里說可以看作為18���。②Al與酸(稀鹽酸����、稀硫酸)反應(yīng)的化學(xué)方程式很容易出錯�。
解答:選B
總結(jié):抓住題目中所提供的物質(zhì)的反應(yīng)特征,抓住平均相對原子質(zhì)量和平均相對分子質(zhì)量的實(shí)質(zhì)�,然后解題,可收到事半功倍的效果����。
新初三快掃碼關(guān)注
中考網(wǎng)微信公眾號
每日推送學(xué)習(xí)技巧���,學(xué)科知識點(diǎn)
助你迎接2020年中考����!
歡迎使用手機(jī)�、平板等移動設(shè)備訪問中考網(wǎng),2023中考一路陪伴同行�!>>點(diǎn)擊查看