╚▄ĮŌČ╚┘|┴┐ĘųöĄ╬’┘|Ą─┴┐ØŌČ╚Ą─ėŗ╦Ń║═ōQ╦Ń
ĪĪĪĪę╗Īóų¬ūRĖ┼ę¬
ĪĪĪ���ĪŻ©ę╗Ż®ėąĻP╚▄ĮŌČ╚Ą─ėŗ╦Ń
ĪĪĪĪį┌ę╗Č©£žČ╚Ž┬Ą─’¢║═╚▄ę║ųą�����Ż¼╚▄┘|���Īó╚▄ä®Īó╚▄ę║ķgėąę╗Č©┴┐Ą─ĻPŽĄ�ĪŻė╔┤╦┐╔▀MąąęįŽ┬ėŗ╦ŃŻ║
ĪĪĪĪŻ©1Ż®Ė∙ō■’¢║═╚▄ę║╚▄┘|�Īó╚▄䮥─┴┐═Ų╦Ń╚▄ĮŌČ╚Ż╗Ż©2Ż®Ė∙ō■╚▄ĮŌČ╚Ū¾╦Ń’¢║═╚▄ę║╦∙║¼Ą─╚▄ä®║═╚▄┘|┴┐Ż╗Ż©3Ż®Ė∙ō■╚▄ĮŌČ╚Ū¾╦Ń’¢║═╚▄ę║į┌š¶░l(f©Ī)Ą¶ę╗Č©┴┐╚▄ä®║¾╬÷│÷Ą─ĮYŠ¦┴┐�Ż╗Ż©4Ż®ė╔ė┌╬’┘|į┌▓╗═¼£žČ╚Ž┬╚▄ĮŌČ╚▓╗═¼Ż¼┐╔ęįĖ∙ō■▓╗═¼£žČ╚Ž┬Ą─╚▄ĮŌČ╚Ū¾╦Ń│÷ę╗Č©┴┐’¢║═╚▄ę║ė╔ė┌£žČ╚Ė─ūāŻ©╗“═¼Ģrėą╚▄ä®┴┐Ė─ūāŻ®�����Ż¼╬÷│÷ĮYŠ¦Ą─┴┐��ĪŻŻ©5Ż®’¢║═╚▄ę║ųą╚▄ĮŌČ╚┼c╚▄┘|Ą─┘|┴┐ĘųöĄĄ─ōQ╦Ń�ĪŻ
ĪĪĪĪę╗Č©£žČ╚Ž┬Ż¼─│’¢║═╚▄ę║╚▄┘|Ą─╚▄ĮŌČ╚Ż║
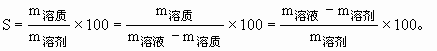
ĪĪĪĪĮŌŅ}Ģrę¬╩ņŠÜ▀\ė├Ž┬┴ą▒╚┴ąĻPŽĄŻ║’¢║═╚▄ę║ųą

ĪĪĪ����ĪŻ©Č■Ż®ėąĻP┘|┴┐ĘųöĄĪó╬’┘|Ą─┴┐ØŌČ╚Ą─ėŗ╦Ń
ĪĪĪĪėąĻP┘|┴┐ĘųöĄĄ─ėŗ╦Ń▒╚▌^║åå╬����Ż¼Ą½ūóęŌā╔³cŻ║ę╗╩Ū║¼ĮYŠ¦╦«╗»║Ž╬’Ą─ØŌČ╚Š∙░┤¤o╦«╬’║¼┴┐ėŗ╦ŃŻ╗Č■╩Ūėąą®╚▄┘|╚▄ĮŌ║¾┼c╦«░l(f©Ī)╔·┴╦Ę┤æ¬����Ż¼Ųõ▓╗─▄ų▒Įė░┤įŁ╬’┘|Ą─┴┐▒Ē╩ŠŻ¼╚ńSO3��ĪóNa2O2╚▄ė┌╦«��Ż¼╚▄ę║ØŌČ╚░┤H2SO4ĪóNaOH║¼┴┐ėŗ╦Ń��ĪŻ
ĪĪĪĪ┼c╬’┘|Ą─┴┐ØŌČ╚ėąĻPĄ─ėŗ╦ŃėąŻ║Ż©1Ż®┼õųŲę╗Č©╬’┘|Ą─┴┐ØŌČ╚╦∙ąĶ╚▄┘|����Īó╚▄ä®┴┐╗“ØŌ╚▄ę║ŽĪßīė├┴┐Ą─ėŗ╦ŃŻ╗Ż©2Ż®Ė∙ō■╦∙╚▄╚▄┘|Ą─┴┐Ū¾╦Ń╬’┘|Ą─┴┐ØŌČ╚���Īóļxūė╬’┘|Ą─┴┐ØŌČ╚�����Ż╗Ż©3Ż®╬’┘|Ą─┴┐ØŌČ╚┼c┘|┴┐ĘųöĄĄ─ōQ╦Ń��ĪŻ
ĪĪĪĪČ■Īó└²Ņ}Ęų╬÷
ĪĪĪĪ└²1ęčų¬─│’¢║═┬╚╗»Ōc╚▄ę║¾wĘe×ķVmL╚▄ę║├▄Č╚×ķdg/cm3��Ż¼┘|┴┐ĘųöĄ×ķwŻź����Ż¼╬’┘|Ą─┴┐ØŌČ╚×ķCmol/LŻ¼╚▄ę║ųą║¼NaClĄ─┘|┴┐×ķmg�ĪŻ
ĪĪĪĪŻ©1Ż®ė├w▒Ē╩Šį┌įō£žČ╚Ž┬NaClĄ─╚▄ĮŌČ╚╩Ū____����ĪŻ
ĪĪĪ�����ĪŻ©2Ż®ė├m�����ĪóV▒Ē╩Š╚▄ę║Ą─╬’┘|Ą─┴┐ØŌČ╚╩Ū____�����ĪŻ
ĪĪĪ�ĪŻ©3Ż®ė├w�����Īód▒Ē╩Š╚▄ę║Ą─╬’┘|Ą─┴┐ØŌČ╚╩Ū____��ĪŻ
ĪĪĪ��ĪŻ©4Ż®ė├c��Īód▒Ē╩Š╚▄ę║Ą─┘|┴┐ĘųöĄ╩Ū____���ĪŻ
ĪĪĪĪĮŌ╬÷Ż║▒ŠŅ}ø]ėąĮo│÷Š▀¾wöĄųĄ���Ż¼ų╗Įo│÷│ķŽ¾Ę¹╠¢�����ĪŻ
ĪĪĪĪĮŌŅ}ĻPµI╩ŪŻ║ę╗ę¬£╩┤_░č╬š’¢║═╚▄ę║╚▄ĮŌČ╚�Īó┘|┴┐ĘųöĄĄ─▒Š┘|ģ^(q©▒)äe║═ŽÓ╗ź┬ō(li©ón)ŽĄ��Ż¼Č■ę¬└ĒĮŌ├▄Č╚╩Ū┘|┴┐ĘųöĄ┼c╬’┘|Ą─┴┐ØŌČ╚ŽÓ╗źōQ╦ŃĄ─ś“┴║��ĪŻ
ĪĪĪ�����ĪŻ©1Ż®ę¬Ū¾░č’¢║═╚▄ę║Ą─┘|┴┐ĘųöĄōQ╦Ń×ķ╚▄ĮŌČ╚Ż║
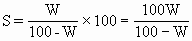
ĪĪĪ��ĪŻ©2Ż®ę¬Ū¾ė├VmL╚▄ę║ųąĄ─╚▄┘|┘|┴┐müĒ▒Ē╩Š╬’┘|Ą─┴┐ØŌČ╚Ż║

ĪĪĪ��ĪŻ©3Ż®ę¬Ū¾░č┘|┴┐ĘųöĄŻ©WŻźŻ®ōQ╦Ń×ķ╬’┘|Ą─┴┐ØŌČ╚Ż║
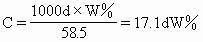
ĪĪĪ��ĪŻ©4Ż®ę¬Ū¾░č╬’┘|Ą─┴┐ØŌČ╚ōQ╦Ń×ķ┘|┴┐ĘųöĄ��Ż¼īŹ┘|╩ŪŻ©3Ż®ąĪŅ}Ą──µ▀\╦ŃŻ║
ĪĪĪĪ└²2ė├Na2SO3║═┴“Ę█į┌╦«╚▄ę║ųą╝ė¤ßĘ┤æ¬�����Ż¼┐╔ųŲĄ├Na2S2O3��ĪŻ10Īµ║═70ĪµĢr���Ż¼Na2S2O3į┌100g╦«ųąĄ─╚▄ĮŌČ╚Ęųäe×ķ60.0g║═212g�����ĪŻ│Ż£žŽ┬�����Ż¼Å─╚▄ę║ųą╬÷│÷Ą─Š¦¾w╩ŪNa2S2O3·5H2O��ĪŻNa2S2O3į┌╦ßąį╚▄ę║ųą┴ó╝┤═Ļ╚½ĘųĮŌŻ║Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaClĪ����Ż¼F╚Ī15.1gNa2SO3�����Ż¼╚▄ė┌80.0mL╦«�����Ż¼┴Ē╚Ī5.00g┴“Ę█Ż¼ė├╔┘įSęę┤╝ØÖر║¾Ż©ęį▒Ń┴“─▄▒╗╦«Į■ØÖŻ®����Ż¼╝ėĄĮ╔Ž╩÷╚▄ę║ųąĪŻė├ąĪ╗╝ė¤ßų┴╬óĘą�Ż¼Ę┤æ¬╝s1h║¾▀^×VĪŻ×Vę║į┌100ĪµĮøš¶░l(f©Ī)��ĪóØŌ┐s�Īó└õģsų┴10Īµ║¾╬÷│÷Na2S2O3·5H2OŠ¦¾wĪŻ
ĪĪĪ�ĪŻ©1Ż®╚¶╝ė╚ļĄ─┴“Ę█▓╗ė├ęę┤╝ØÖرŻ¼ī”Ę┤æ¬Ą─ė░Ēæ╩Ū______����ĪŻŻ©╠Ņīæ▀xĒŚūų─ĖŻ®
ĪĪĪĪAŻ«Ģ■ĮĄĄ═Ę┤æ¬╦┘┬╩BŻ«ąĶę¬╠ßĖ▀Ę┤欣žČ╚
ĪĪĪĪCŻ«īóį÷┤¾Ę┤款wŽĄĄ─pHDŻ«Ģ■£p╔┘«a┴┐
ĪĪĪĪŻ©2Ż®Ę┤æ¬1h║¾▀^×V����Ż¼Ųõ─┐Ą─╩Ū_______ĪŻ
ĪĪĪ�ĪŻ©3Ż®×Vę║ųą│²Na2S2O3║═┐╔─▄╬┤Ę┤æ¬═Ļ╚½Ą─Na2SO3═Ō��Ż¼ūŅ┐╔─▄┤µį┌Ą─¤oÖCļs┘|╩Ū_______ĪŻ╦³╩Ūė╔_______«a╔·Ą─�ĪŻ╚ń╣¹×Vę║ųąįōļs┘|Ą─║¼┴┐▓╗║▄Ą═Ż¼ŲõÖz£yĄ─ĘĮĘ©╩ŪŻ║______��ĪŻ
ĪĪĪ����ĪŻ©4Ż®įONa2SO3Ė·┴“Ę█═Ļ╚½Ę┤æ¬Ż¼«öīó×Vę║š¶░l(f©Ī)ØŌ┐s║¾��Ż¼└õģsų┴70Īµ�����Ż¼╚▄ę║Ą─¾wĘe╝s30mL��Ż¼įō╚▄ę║╩Ūʱ▀_ĄĮ’¢║═���Ż┐įć═©▀^ėŗ╦Ńšf├„Ż©70ĪµĢr��Ż¼Na2S2O3’¢║═╚▄ę║Ą─├▄Č╚×ķ1.17g/cm3Ż®��ĪŻ
ĪĪĪ�ĪŻ©5Ż®╚¶ę¬ėŗ╦Ńį┌100ĪµŽ┬īó╚▄ę║š¶░l(f©Ī)ų┴¾wĘe×ķ30.0mLŻ¼į┘└õģsų┴10ĪµĢr╦∙─▄Ą├ĄĮĄ─Na2S2O3·5H2OĄ─┘|┴┐���Ż¼─ŃšJ×ķ_______���ĪŻŻ©╠Ņīæę╗éĆ▀xĒŚĄ─ūų─ĖŻ®
ĪĪĪĪAŻ«Ū░├µ╠ß╣®Ą─öĄō■ęčĮøūŃē“
ĪĪĪĪBŻ«▀ĆąĶę¬╠ß╣®100ĪµĢr╚▄ę║Ą─├▄Č╚Ż©1.14g/cm3Ż®
ĪĪĪĪCŻ«▀ĆąĶę¬╠ß╣®ĮYŠ¦║¾╩ŻėÓ╚▄ę║Ą─¾wĘeŻ©10.0mLŻ®
ĪĪĪĪŻ©6Ż®Ė∙ō■Ą┌Ż©5Ż®ąĪŅ}─ŃĄ─▀xō±Ż©╚ń▀xAätų▒Įėėŗ╦Ń��Ż¼╚ń▀xB╗“Cät┐╔▀xė├ŲõöĄō■Ż®�Ż¼ėŗ╦ŃÅ─10ĪµŻ¼30.0mL╚▄ę║ųąĮYŠ¦Č°│÷Ą─Na2S2O3·5H2OĄ─┘|┴┐�ĪŻ
ĪĪĪĪĮŌ╬÷Ż║Ż©1Ż®┴“▓╗╚▄ė┌╦«Ż¼╬ó╚▄ė┌ŠŲŠ½�����ĪŻŅ}Įoą┼Žó“ė├ęę┤╝ØÖر║¾Ą─┴“─▄▒╗╦«Į■ØÖ”��Ż¼╚¶▓╗ė├ęę┤╝ØÖر┴“Ę█����Ż¼ät┴“▒ž╚╗┼c╦«╚▄ę║ųąĄ─Na2SO3“Įėė|▓╗┴╝”Č°ĮĄĄ═Ę┤æ¬╦┘┬╩Ż¼▓óĢ■£p╔┘«a┴┐�����Ż¼┤░Ėæ¬▀xAĪóD��ĪŻ
ĪĪĪ����ĪŻ©2Ż®Na2SO3+S=Na2S2O3
ĪĪĪĪn(S)=5/32=0.16(mol)�Ż¼
ĪĪĪĪn(Na2SO3)=15.1/126=0.12(mol)
ĪĪĪĪ┴“Ę█▀^┴┐ĪŻĘ┤æ¬1h║¾▀^×V���Ż¼Ųõ─┐Ą─╩Ū│²╚ź▀^┴┐Ą─┴“Ę█��ĪŻ
ĪĪĪ����ĪŻ©3Ż®ė╔ė┌Na2SO3▓╗ĘĆ(w©¦n)Č©��Ż¼į┌│©ķ_╚▌Ų„ųąė┌100Īµ╚▄ę║ųą▒Ż│ųĘą“vŽ┬Ę┤æ¬ķL▀_1h���Ż¼║▄╚▌ęū▒╗┐šÜŌč§╗»│╔Na2SO4�ĪŻ

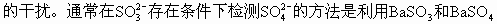
ĪĪĪĪČ╝▓╗╚▄ė┌╦«�Ż¼Ą½BaSO3╚▄ė┌╦ßČ°BaSO4▓╗╚▄ė┌╦߯¼╝ėŽĪHCl╝┤┐╔Öz£y│÷���ĪŻ
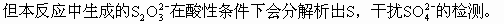
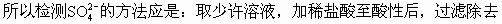
ĪĪĪĪS��Ż¼į┘╝ėBaCl2╚▄ę║�����ĪŻ
ĪĪĪ�����ĪŻ©4Ż®Ż©ĮŌĘ©ę╗Ż®ėŗ╦Ń╔·│╔Ą─Na2S2O3į┌70ĪµĢr’¢║═╚▄ę║æ¬ėąĄ─¾wĘe��Ż¼īó╦³Ė·Ņ}įO30mLŽÓ▒╚▌^�ĪŻ
ĪĪĪĪ╚¶Ę┤æ¬Ą├ĄĮĄ─Na2S2O3į┌70ĪµĢr┼õ│╔’¢║═╚▄ę║Ż¼Ųõ¾wĘe×ķx�����Ż¼ät
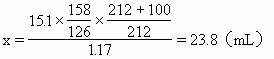
ĪĪĪĪę“23.8mLŻ╝30mL╦∙ęįš¶░l(f©Ī)║¾Ą─╚▄ę║╔ą╬┤▀_ĄĮ’¢║═��ĪŻ
ĪĪĪ�����ĪŻ©ĮŌĘ©Č■Ż®ėŗ╦Ń70ĪµĢr30mL’¢║═╚▄ę║ųąæ¬║¼Na2S2O3Ą─┘|┴┐�����Ż¼īó╦³Ė·Ę┤æ¬Ą├ĄĮĄ─Na2S2O3Ą─┘|┴┐ŽÓ▒╚▌^ĪŻ
ĪĪĪĪ╚¶įō╚▄ę║╩Ū’¢║═╚▄ę║��Ż¼Ųõ╦∙║¼Na2S2O3Ą─┘|┴┐×ķx���Ż¼ät
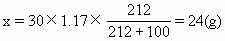
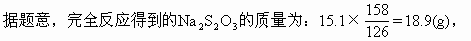
ĪĪĪĪ18.9gŻ╝24gŻ¼╚▄ę║╔ą╬┤▀_ĄĮ’¢║═�ĪŻ
ĪĪĪĪŻ©5Ż®Ū░Ņ}ųąęčų¬╔·│╔Ą─Na2S2O3Ą─┘|┴┐×ķ18.9g��Ż¼╚ń╣¹ę¬Ū¾Ą├10ĪµĢr30mL╚▄ę║╦∙╬÷│÷Ą─Na2S2O3·5H2OĄ─┘|┴┐���Ż¼▀Ćæ¬įōų¬Ą└╚▄ę║ųą╦«Ą─┘|┴┐�����Ż¼Č°╚▄ę║ųą╦«Ą─┘|┴┐=╚▄ę║┘|┴┐ŻŁNa2S2O3Ą─┘|┴┐����Ż¼╚▄ę║Ą─┘|┴┐=╚▄ę║Ą─¾wĘeŻ©30mLŻ®×╚▄ę║Ą─├▄Č╚����ĪŻę“┤╦��Ż¼▀ĆąĶę¬ų¬Ą└100ĪµĢr╚▄ę║Ą─├▄Č╚�Ż¼æ¬▀xBĒŚ�����ĪŻ
ĪĪĪ�����ĪŻ©6Ż®įOĘ┤æ¬Ą├ĄĮĄ─Na2S2O3·5H2OĄ─┘|┴┐×ķx����Ż¼ätxųąNa2S2O3
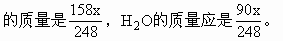
ĪĪĪĪ╚▄ę║ųą╦«Ą─┘|┴┐=30×1.14-18.9=15.3(g)
ĪĪĪĪĖ∙ō■10ĪµĢrĄ─╚▄ĮŌČ╚Ż¼╬÷│÷Š¦¾w║¾Ą─╚▄ę║ę╗Č©╩Ū’¢║═╚▄ę║�����Ż¼ätėą

ĪĪĪĪĮŌĄ├Ż║x=23.2Ż©gŻ®
ĪĪĪĪ╚²��ĪóŠÜ┴Ģ┼cÖz£y
ĪĪĪĪ1Ż«tĪµĢr�����Ż¼Na2CO3Ą─╚▄ĮŌČ╚×ķAg���Ż¼¼Fėą’¢║═Na2CO3╚▄ę║Ż©100+AŻ®g�����Ż¼Ųõ╚▄┘|Ą─┘|┴┐ĘųöĄ×ķaŻź���Ż¼Ž“╚▄ę║ųą═Č╚ļ¤o╦«Na2CO3╣╠¾wAg�����Ż¼ņoų├║¾╬÷│÷╔┘┴┐Š¦¾wŻ©Na2CO3·10H2OŻ®Ż¼╝ė╦«╩╣Š¦¾w╚½▓┐╚▄ĮŌ���Ż¼╦∙Ą├╚▄ę║╚į×ķ’¢║═╚▄ę║��Ż¼╝ė╚ļĄ─╦«╩Ū[]
ĪĪĪĪAŻ«100gBŻ«(100+A)g

ĪĪĪĪ2Ż«ėąX���ĪóYĪóZ╚²ĘN¹}�����Ż¼ęčų¬Ż║
ĪĪĪ��ĪŻ©1Ż®25ĪµĢrŻ¼X’¢║═╚▄ę║Ųõ╚▄┘|┘|┴┐ĘųöĄ×ķ15Żź�Ż╗
ĪĪĪĪŻ©2Ż®25ĪµĢr�����Ż¼į┌100g┘|┴┐ĘųöĄ×ķ10ŻźĄ─Y╚▄ę║ųą╝ė╚ļ5gYŻ©¤o╦«¹}Ż®║¾�����Ż¼ŪĪ║├▀_ĄĮ’¢║═����Ż╗
ĪĪĪĪŻ©3Ż®25ĪµĢr����Ż¼īóę╗Č©┴┐Z╚▄ę║š¶░l(f©Ī)Ą¶5.75g╦«į┘╗ųÅ═ĄĮ25ĪµŻ¼╗“▒Ż│ųį┌25ĪµŽ“Ųõųą╝ė╚ļ6.3gZĄ─ĮYŠ¦╦«║Ž╬’Ż©Z·9H2O�����Ż¼─”Ā¢┘|┴┐=240Ż®����Ż¼Č╝ŪĪ║├ą╬│╔’¢║═╚▄ę║��ĪŻ
ĪĪĪĪät25ĪµĢr����Ż¼X��ĪóY�����ĪóZĄ─╚▄ĮŌČ╚Ż©ųĖ¤o╦«¹}Ż®┤¾ąĪĒśą“š²┤_Ą─╩Ū[]
ĪĪĪĪAŻ«XŻŠYŻŠZBŻ«ZŻŠYŻŠX
ĪĪĪĪCŻ«YŻŠZŻŠXDŻ«ZŻŠXŻŠY
ĪĪĪĪ3Ż«╚Ī50mL2mol/LĄ─┴“╦ß╚▄ę║�����Ż¼Ė·6.5gĮī┘õ\│õĘųĘ┤æ¬���Ż¼╝ė¤ßš¶░l(f©Ī)16.2g╦«Ż¼▓ó└õģsų┴10ĪµĢr�Ż¼┐╔╬÷│÷ZnSO4·7H2OČÓ╔┘┐╦Ż©10ĪµĢrZnSO4╚▄ĮŌČ╚×ķ32gŻ¼┴“╦ß├▄Č╚1.12g/cm3Ż®�Ż┐
ĪĪĪĪ4Ż«AĪóBā╔ĘN╗»║Ž╬’Ą─╚▄ĮŌČ╚Ū·ŠĆ╚ńŽ┬łD╦∙╩Š���Ż¼¼Fę¬ė├ĮYŠ¦Ę©Å─A����ĪóB╗ņ║Ž╬’ųą╠ß╚ĪAŻ©▓╗┐╝æ]AĪóB╣▓┤µĢr����Ż¼ī”Ė„ūį╚▄ĮŌČ╚Ą─ė░ĒæŻ®
ĪĪĪĪŻ©1Ż®╚Ī50g╗ņ║Ž╬’�Ż¼īó╦³╚▄ė┌100g¤ß╦«Ż¼╚╗║¾└õģsų┴20Īµ����ĪŻ╚¶ę¬╩╣A╬÷│÷Č°B▓╗╬÷│÷Ż¼ät╗ņ║Ž╬’ųąBĄ─┘|┴┐ĘųöĄŻ©BŻźŻ®ūŅĖ▀▓╗─▄│¼▀^ČÓ╔┘���Ż┐Ż©īæ│÷═Ų└Ē╝░ėŗ╦Ń▀^│╠Ż®
ĪĪĪ����ĪŻ©2Ż®╚ĪWg╗ņ║Ž╬’���Ż¼īó╦³╚▄ė┌100g¤ß╦«���Ż¼╚╗║¾└õģsų┴10ĪµĪŻ╚¶╚įę¬╩╣A╬÷│÷Č°B▓╗╬÷│÷Ż¼šłīæ│÷į┌Ž┬┴ąā╔ĘNŪķørŽ┬����Ż¼╗ņ║Ž╬’ųąAĄ─┘|┴┐ĘųöĄŻ©AŻźŻ®æ¬ØMūŃ╩▓├┤ĻPŽĄ╩ĮŻ┐Ż©ęįW���Īóa���Īób▒Ē╩ŠŻ¼ų╗ąĶīó┤░Ė╠Ņīæį┌Ž┬┴ąÖMŠĆĄ─┐š░ū╠Ä�ĪŻŻ®
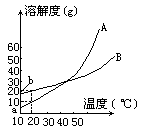
ĪĪĪĪ«öwŻ╝a+bĢr____
ĪĪĪĪ«öwŻŠa+bĢr____
ĪĪĪĪ5Ż«│Ż£žŽ┬A║═Bā╔ĘNÜŌ¾wĮM│╔╗ņ║Ž╬’ÜŌ¾wŻ©AĄ─ŽÓī”Ęųūė┘|┴┐┤¾ė┌BĄ─ŽÓī”Ęųūė┘|┴┐Ż®Ż¼ĮøĘų╬÷�Ż¼╗ņ║ŽÜŌ¾wųąų╗║¼ėąĄ¬║═Üõā╔ĘNį¬╦žŻ╗Č°Ūę�Ż¼▓╗šōA║═Bęį║╬ĘN▒╚└²╗ņ║ŽŻ¼Ą¬║═ÜõĄ─┘|┴┐▒╚┐é┤¾ė┌14/3���ĪŻė╔┤╦┐╔┤_Č©A×ķ____����Ż¼B×ķ____��ĪŻŲõ└Ēė╔╩Ū____���ĪŻ╚¶╔Ž╩÷╗ņ║ŽÜŌ¾wųąĄ¬║═ÜõĄ─┘|┴┐▒╚×ķ7Ī├1����Ż¼ätį┌╗ņ║ŽÜŌ¾wųąA║═BĄ─╬’┘|Ą─┴┐ų«▒╚×ķ____���Ż╗Aį┌╗ņ║ŽÜŌ¾wųąĄ─¾wĘeĘųöĄ×ķ____Żź���ĪŻ
ĪĪĪĪ║åå╬┤░Ė
ĪĪĪĪ1Ż«AŻ╗2Ż«D����Ż╗3Ż«15.5gŻ╗
ĪĪĪĪ4Ż«Ż©1Ż®į┌20ĪµĢr���Ż¼╚¶ę¬B▓╗╬÷│÷�Ż¼įō╚▄ę║ųąBĄ─┘|┴┐▓╗─▄│¼▀^20g�����Ż¼ė╔ė┌A�����ĪóB┘|┴┐╣▓50gŻ¼╦∙ęį▀@ĢrAĄ─┘|┴┐│¼▀^30g���Ż¼┤¾ė┌╦³Ą─╚▄ĮŌČ╚���Ż¼A╬÷│÷Ż¼Ę¹║ŽŅ}ęŌ����ĪŻ╝┤50g×BŻź≤20gŻ¼BŻź≤40Żź���ĪŻ
ĪĪĪ�����ĪŻ©2Ż®«öWŻ╝a+bĢr�����Ż¼AŻźŻŠa/w��Ż╗«öWŻŠa+bĢr��Ż¼AŻź≥W-b/WŻ╗
ĪĪĪĪ5Ż«NH3N2╝āNH3ÜŌ¾wųąĄ¬║═ÜõĄ─┘|┴┐▒╚×ķ14/3Ż¼į┌╝āNH3ųą╗ņ╚ļ╚╬║╬▒╚└²Ą─N2Č╝īó╩╣Ą¬║═ÜõĄ─┘|┴┐▒╚┤¾ė┌14/34Ī├180Żź���ĪŻ
ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖC�����ĪóŲĮ░ÕĄ╚ęŲäėįOéõįLå¢ųą┐╝ŠW���Ż¼2024ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąąŻĪ>>³cō¶▓ķ┐┤









